규제완화 여파...원료약 등록 1년새 237→653건
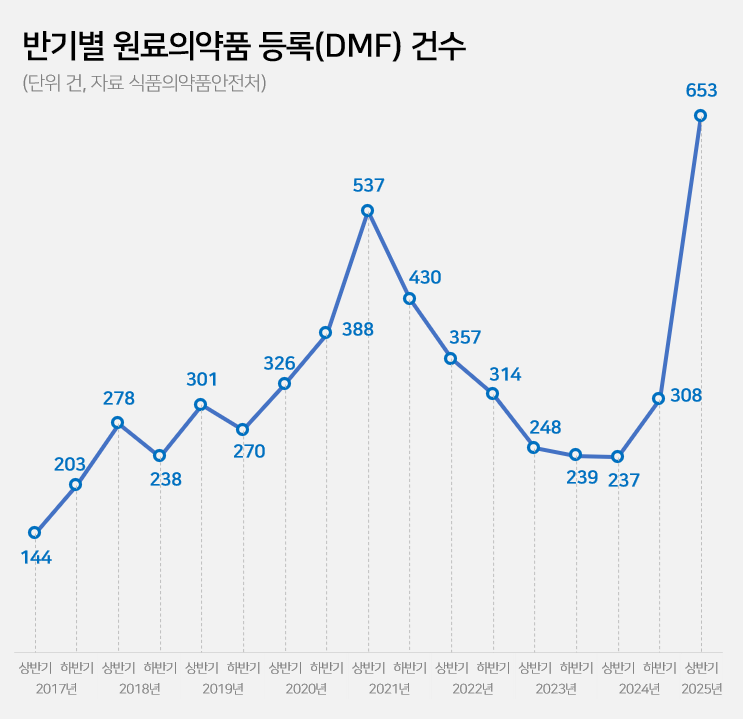
상반기 원료의약품 등록(DMF) 건수가 전년동기 대비 2.8배 급증했다. 반기 기준으로 역대 최고 수준이다.
연초 원료의약품 등록 요건이 완화된 영향으로 풀이된다. 정부는 올해부터 원료의약품 등록 시 GMP 평가를 GMP 증명서로 대체할 수 있도록 규제를 완화한 바 있다.
상반기 DMF 653건 ’역대 최고‘…전년동기 대비 2.8배 급증
26일 식품의약품안전처에 따르면 올해 상반기 국내 제약바이오기업의 원료의약품 등록 건수는 653건이다.
작년 상반기 256건과 비교하면 1년 새 2.8배 증가했다. 이미 작년 전체 원료약 등록 건수(545건)를 넘어섰다. 반기별 원료약 등록 건수로는 2021년 상반기(537건)을 넘어 역대 최고 수준이다.
DMF 건수가 급등한 배경으로 정부의 규제 완화가 지목된다. 식품의약품안전처는 올해 초 현장 실사를 GMP 증명서로 대체하는 내용으로 DMF 제도를 개편했다.
기존에는 DMF 신청을 위해 현장 실사와 함께 제조시설 자료, 생산국 제조 증명서, GMP 자료 11종 등을 제출해야 했다. 올해부턴 현장 실사가 폐지됐다. 또한 생산국 정부기관 또는 PIC/S 가입국이 발급한 GMP 증명서로 기존 자료를 대체했다. 행정처리 기간도 120일에서 20일로 단축됐다.
식품의약품안전처 관계자는 ”원료의약품 등록을 위해 예전엔 GMP 실사를 받아야 했지만, 올해부턴 증명서로 갈음할 수 있게 됐다“며 ”기존에 1000건 가까이 쌓여 있던 DMF 신청이 올해 들어 대거 처리됐고, 이 과정에서 DMF 건수가 급증한 것으로 보인다“고 설명했다.
원료약 품질 검증 우려…식약처 ”고위험 품목 현장실사 유지“
이번 규제 완화를 두고 제약업계 일각에선 원료의약품 품질 관리가 허술해질 수 있다는 우려가 제기된다. GMP 증명서만으로 등록이 가능해지면서, 문서 위주 평가로는 품질 이슈를 사전에 걸러내기 어렵다는 지적이다.
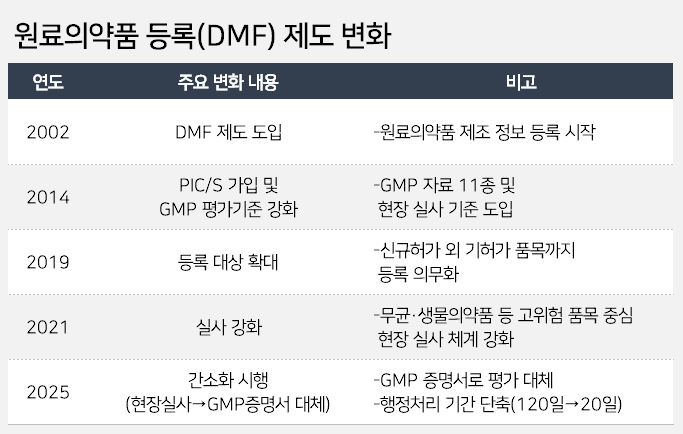
이번 규제 완화는 과거 식약처의 기조와는 정반대 흐름이다. 식약처는 지난 2002년 DMF 제도를 도입한 이후로 꾸준히 품질관리를 강화해왔다. 2014년엔 PIC/S 가입에 따라 GMP 평가기준을 강화했다. GMP 자료 11종과 현장실사 기준이 이때 도입됐다. 2019년엔 신규 품목뿐 아니라 기허가 품목까지 DMF 등록이 의무화됐다. 2021년엔 고위험 품목을 중심으로 현장실사 체계를 더욱 강화했다.
식약처는 지난해 열린 제도 설명회에서 DMF 신청 급증으로 행정 병목 현상이 심화되고 완제의약품 심사까지 지연되자, 대응 차원에서 평가체계를 조정했다고 설명했다. 전반적으로는 GMP 정책을 ’완제의약품 중심‘으로 전환한다는 게 식약처 방침이다.
원료의약품 품질 우려에 대해선 고위험 품목의 경우 예외적으로 현장 실사를 유지하고 있으며, GMP 증명서 요건도 국제 기준에 맞춰 엄격히 설정했다는 입장이다. 실제 생물의약품이나 무균 원료의약품 등 고위험 품목은 여전히 실사와 평가자료 제출이 요구된다.
또한 의약품 허가·적합 판정에 있어선 현장 실사를 기존대로 유지했다. 나아가 ’제조소 총람(Site Master File)‘ 개념을 도입해 제조소의 품질관리체계를 종합적으로 파악할 수 있도록 한다는 계획이다.
제도 변화 따라 등락 반복…2021년 정점 후 감소세→올해 다시 반등
국내 제약바이오기업의 DMF 건수는 제도 변화와 정책적 요인에 따라 매년 큰 폭으로 변동했다.
최근 8년간 DMF 건수는 ▲2017년 347건 ▲2019년 516건 ▲2019년 571건 ▲2020년 714건 ▲2021년 967건 ▲2022년 671건 ▲2023년 487건 ▲2024년 545건 등으로 들쭉날쭉한 모습을 보였다. 올해는 상반기에만 653건으로, 연말 1000건 돌파 가능성이 제기된다.
2021년 DMF 급증은 기허가 품목까지 원료약 등록을 의무화한 정책과 맞물려 발생했다. 식약처는 2019년 DMF 대상을 기존 ’신규허가 품목‘에서 ’기허가 품목‘으로 확대했다. 이 가운데 상용의약품은 2021년까지 등록을 마치도록 했고, DMF 신청이 집중됐다는 분석이다.
비슷한 시기 진행된 약가제도 개편도 DMF 증가에 영향을 끼쳤다. 정부는 2019년 7월 ’계단형 약가제도‘를 도입했다. 최고가 요건을 갖추지 못한 제네릭의 경우 ‘생동성시험 수행’과 ‘등록 원료의약품 사용’ 자료를 제출하면 종전 약가를 유지해주기로 했다. 이에 약가를 유지하기 위한 제약바이오기업들의 DMF 신청이 잇따랐다.
https://www.dailypharm.com/Users/News/NewsView.html?ID=324241